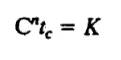|
为什么说次氯酸(HClO)的杀菌能力是次氯酸根(ClO-)的80-100倍想必行业内的人都听过次氯酸杀菌效果的介绍:“次氯酸分子(HClO)的杀菌能力是次氯酸根离子(ClO-)的80-100倍”,那么这个论断是依据是什么?出自哪里呢? 既然我们一直讲:同等有效氯浓度条件下,次氯酸水的杀菌效果是远好于次氯酸钠的,到底好在哪里?且听如下分解: 1 在本文之前有几个专业概念,介绍如下: CT值 concentration-time value; CT 消毒剂的浓度和作用时间的乘积,用于比较消毒剂杀菌作用的指标。这个概念很重要,是我们得出最终结论的重要依据之一。 奇克定律 Chick’s law 奇克最早阐述了消毒过程中的规律,认为消毒过程类似于双分子化学反应,只不过反应物分别是消毒剂与微生物,可以用化学反应速率描述。 自由性氯 Free chlorine 自由氯是Cl2、HOCl 与OCl-的统称。
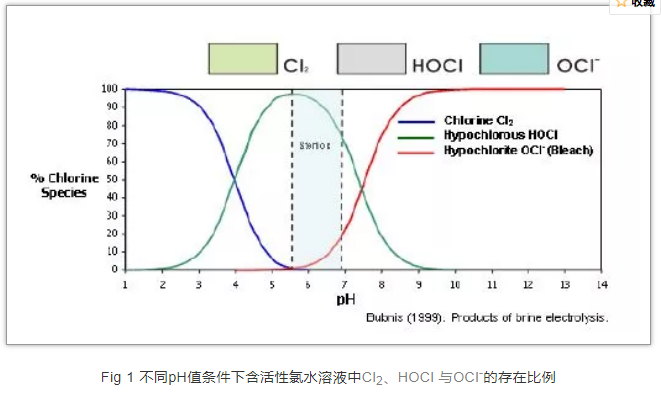
在中性条件下,氯气溶于水产生次氯酸(HClO),溶液显示酸性;在碱性条件下,氯气溶于水产生次氯酸根离子(ClO-)。
化合性氯 Combined chlorine 与自由性氯相对的是化合性氯,化合性氯是指所含的氯以氯胺形式存在,当水中有氨存在时,氯加入含有氨氮的水中后会发生可逆反应,并生成一氯胺(NH3Cl)、二氯胺、三氯胺。氯胺的消毒也是依靠次氯酸(HOCl ),即氯胺的消毒作用来自于上述可逆反应中维持平衡所不断释放出来的次氯酸。因此,氯胺的消毒效果慢而持续。 2 次氯酸分子(HClO)与次氯酸根离子(ClO-)在杀菌原理上存在差异,我们采用日本科学家Fukuzaki教授2006年发表在《Biocontrol Science》上的论文来解释其杀菌原理:
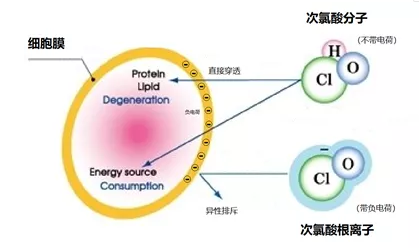
Fig 2 次氯酸分子(HClO)与次氯酸根离子(ClO-)的杀菌原理差异 如上图所示,细胞膜表面是带有负电荷的,因此次氯酸根(ClO-,也是带负电荷)不能轻易进入细胞内部,而次氯酸(HClO)是中性小分子,可以穿透细胞膜,进入细胞内部,并与其内部的DNA和线粒体发生反应,使其死亡。这也就在一定程度上解释了同等有效氯的情况下,为什么次氯酸(HClO)的杀菌能力比次氯酸钠(NaClO)的原因。 3 1948年,英国剑桥大学的Gordon M. F等在亚特兰大的一次学术会议上,发表了题为“Fair G M , Morris J C , Chang S L , et al. The Behavior of Chlorine as a Water Disinfectant[J]. Journal, 1948, 40(10):1051-1061.”的文章,其中明确指出次氯酸根离子(ClO-)的杀菌能力只有次氯酸分子(HClO)的1/80,详情如下:
进一步,我们再来来解释该结论是如何得出的…… 通常情况下,消毒剂的消毒速度可以用Chick定律(1908年)来表示,即: -dN/dt=kN N:t 时刻活的微生物数量;k为反应速率常数;t为反应时间。
反应速率常数k取决于微生物的种类、消毒剂的类型及其性质、消毒剂的浓度以及环境因素,如pH值和温度。 Chick定律在应用上有些许局限,因此,Butterfield等在此基础上修正得出了以下经验公式:
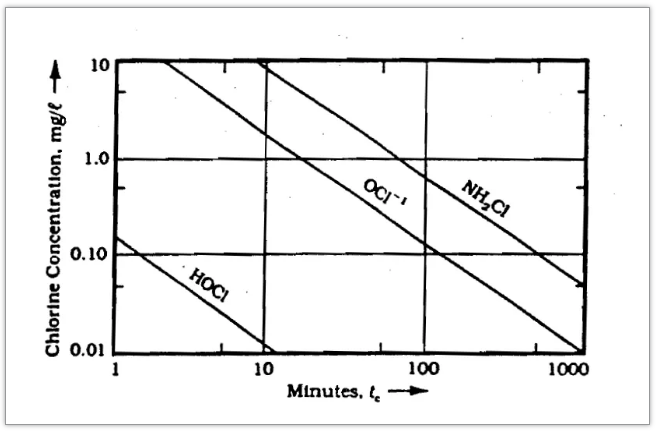
其中,C为在时间t=0时消毒剂的浓度 tc为对某种微生物达到指定杀灭率所需要的时间 K,n为试验常数 随后,Butterfield等研究了在温度为2℃-6℃条件下,次氯酸分子(HClO)和次氯酸根离子(ClO-)对大肠杆菌杀灭率达99%时的消毒剂浓度和消毒时间,其结果如下:
Fig 3 不同形式的氯化物对大肠杆菌杀灭率达到99%对应的时间和浓度(温度2℃-6℃) 次氯酸分子(HClO)与次氯酸根离子(ClO-)的杀菌能力差异倍数: a=(C×T)ClO- /(C×T)HClO 当C=0.10mg/L时,次氯酸分子(HClO)与次氯酸根离子(ClO-)对应的横坐标倍数的差异即为两者的杀菌能力差异,即80倍左右(由于原文出处年代久远,已有70余年时间,有缺失)。 4 但是在实际使用过程,因为酸性电解水/次氯酸水的使用浓度比较低,且次氯酸的消毒效果容易受到有机物的干扰,以及其他试验条件的影响(如温度、pH值、微生物类型等),因此两者的消毒效果差异并不能达到80-100倍的理想值。 但是,这并不影响酸性电解水/次氯酸水在使用安全性、环保性上具有的巨大优势,毫不夸张的说:酸性电解水/次氯酸水是当前最优秀的消毒产品之一。 参考文献: Butterfield, C. T, Wattie, Elsie. Influence of pH and Temperature on the Survival of Coliforms and Enteric Pathogens When Exposed to Chloramine[J]. Public Health Reports, 61(6):157. Noyes R. 95/05427 Unit operation in environmental engineering[J]. Fuel & Energy Abstracts, 36(5):377. Fair G M , Morris J C , Chang S L , et al. The Behavior of Chlorine as a Water Disinfectant[J]. Journal, 1948, 40(10):1051-1061. |